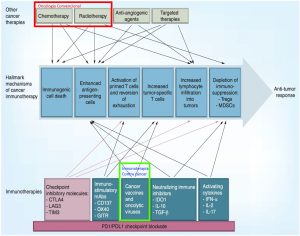
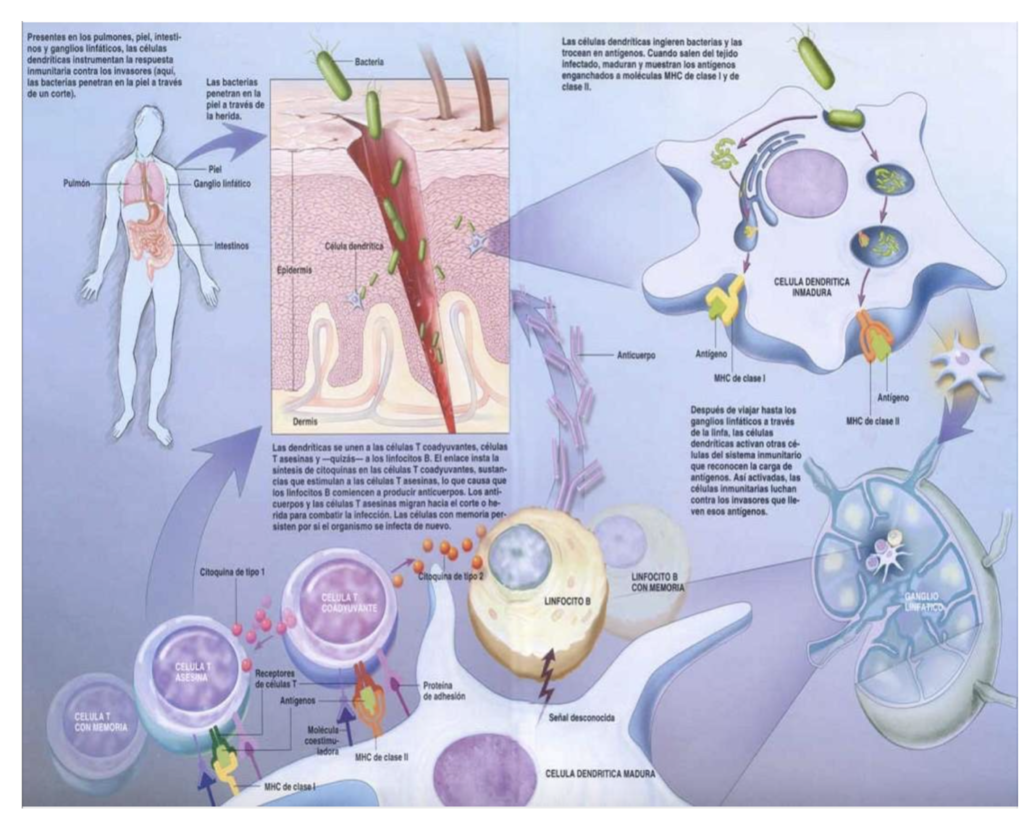
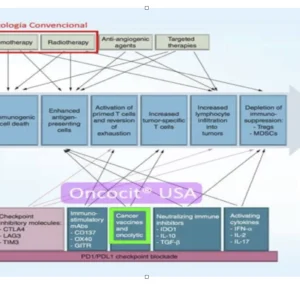
Inmunoterapia CD en cáncer
SOPORTE BIBLIOGRAFICO DE RESPALDO EN INMUNOTERAPIA PERSONALIZADA
1. http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1137-66272015000200012
2. http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802016000500009
4. https://www.canceractive.com/cancer-active-page-link.aspx?n=3080
5. https://www.researchgate.net/publication/7810215_Immunotherapy_Via_Dendritic_Cells
6. http://medcraveonline.com/IJVV/IJVV-01-00002.pdf
7. http://medcraveonline.com/IJVV/IJVV-04-00081.pdf
8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3788678/pdf/nihms511491.pdf
9. http://www.ias.ac.in/article/fulltext/jbsc/042/01/0161-0173
10. Kajihara, M., Takakura, K., Kanai, T., Ito, Z., Saito, K., Takami, S., … Koido, S. (2016). Dendritic cell-based cancer immunotherapy for colorectal cancer. World Journal of Gastroenterology, 22(17), 4275–4286. http://doi.org/10.3748/wjg.v22.i17.4275
11. Safety and preliminary evidence of biologic efficacy of a mammaglobin-a DNA vaccine in patients with stable metastatic breast cancer.Tiriveedhi V et al. Clin Cancer Res. 2014 Dec 1;20(23):5964-75.
12. Granulocyte macrophage colony-stimulating factor–secreting allogeneic cellular immunotherapy forhormone- refractory prostate cancer. Small EJ et al. Clin Cancer Res. 2007 Jul 1;13(13):3883-91.
13. Increased anti-tumor immunity that correlates with clinical benefit and induction of neoantigens reactivityfollowing autologous tumor lysate-pulsed dendritic cells vaccination in recurrent ovarian cancer- Ophir E,Bobisse, S, Kandalaft L.E., Tanyi J., Genolet, R, Zsiros E, Torigian D, Mick, R, Harrari A and Coukos G. CIMT May 2015
14. Autologous oxidized whole-tumor antigen vaccine in combination with angiogenesis blockade elicits antitumor immune response in ovarian cancer- Tanyi J., Kandalaft L.E., Ophir E, Bobisse, Genolet, R, ZsirosE, Torigian D, Mick, R, Harrari A and Coukos G. ASCO June 2015
15. Adjuvant active specific immunotherapy for human colorectal cancer: 6.5- year median follow-up of a phase III prospectively randomized trial. Hoover HC Jr et al. (1993) J Clin Oncol 11:390–399
16. Adjuvant active specific immunotherapy of stage II and stage III colon cancer with an autologous tumor cell vaccine: first randomized phase III trials show promise. Hanna MG, et al. Vaccine. 2001;19:2576–2582
17. Phase I trial of a multi-epitope-pulsed dendritic cell vaccine for patients with newly diagnosed glioblastoma. Phuphanich S et al. Cancer Immunol Immunother. 2013 Jan;62(1):125-35. doi: 10.1007/s00262-012-1319-0. Epub 2012 Jul 31.
18. Survival with AGS-003, an autologous dendritic cell-based immunotherapy, in combination with sunitinibin unfavorable risk patients with advanced renal cell carcinoma (RCC): Phase 2 study results. Amin A et al.J Immunother Cancer. 2015 Apr 21;3:14. doi: 10.1186/s40425-015- 0055-3. eCollection 2015.
19. A phase II study of active specific immunotherapy and5-FU/Leucovorin as adjuvant therapy for stage III colon carcinoma. A Baars et al. Br J Cancer. 2002 April 22; 86(8): 1230–1234.
20. Phase II randomized controlled trial of an epidermal growth factor vaccine in advanced non- small-cell lungcancer. Neninger Vinageras, E. et al. J. Clin. Oncol. 26, 1452–1458 (2008).
21. Immunotherapy of hepatocellular carcinoma: Unique challenges and clinical opportunities. Angela D. Pardee, Lisa H. Butterfield. Oncoimmunology. 2012 Jan 1; 1(1): 48–55. doi: 10.4161/onci.1.1.18344
22. Dendritic cell vaccines: A review of recent developments and their potential pediatric application. Hum Vaccin Immunother. 2016 Sep; 12(9): 2232–2239. Cancer testis antigen and immunotherapy. Immunotargets Ther. 2013; 2: 11–19.
23. Cellular immunotherapy for pediatric solid tumors. Cytotherapy. 2015 Jan; 17(1): 3–17.
24. Intratumoral Immunization: A New Paradigm for Cancer Therapy. Clin Cancer Res. 2014 Apr 1; 20(7):1747–1756.
25. Complete Remission Following Decitabine/Dendritic Cell Vaccine for Relapsed Neuroblastoma. Pediatrics(2013;131[1]:e336–e341.
26. Immunotherapy advances in uro-genital malignancies. Critical Reviews in Oncology/Hematology 105(2016) 52–64
27. Draube, A., Klein-González, N., Mattheus, S., Brillant, C., Hellmich, M., Engert, A., & von Bergwelt- Baildon,
M. (2011). Dendritic cell based tumor vaccination in prostate and renal cell cancer: a systematic reviewand meta-analysis. PloS one, 6(4), e18801.
28. Berntsen, A., Geertsen, P. F., & Svane, I. M. (2006). Therapeutic dendritic cell vaccination of patients withrenal cell carcinoma. European urology, 50(1), 34-43.
29. Emerging immunotherapies for renal cell carcinoma. Ann. Escudier, B., 2012. Oncol. 23, 35–40.
30. Hawiger, D., Inaba, K., Dorsett, Y., Guo, M., Mahnke, K., Rivera, M., et al., 2001. Dendritic cells induce peripheral T cell unresponsiveness under steady state conditions in vivo. J. Exp. Med. 194, 769–779.
31. Noessner, E., Brech, D., Mendler, A., Masouris, I., Schlenker, R., Prinz, P., 2012. Intratumoral alterations of dendritic-cell differentiation and CD8(+) T-cell anergy are immune escape mechanisms of clear cell renal cell carcinoma. Oncoimmunology 1, 1451–1453.
32. Genetic immunotherapy for cancer. Oncologist. 2000;5(2):87-98.
33. Immunotherapy of Autologous Tumor Lysate-loaded Dendritic Cell Vaccines by a Closed-flow Electroporation System for Solid Tumors . ANTICANCER RESEARCH 33: 2971-2976 (2013)
34. Autologous Tumor Lysate-pulsed Dendritic Cell Immunotherapy for Pediatric Patients with NewlyDiagnosed or Recurrent High- grade Gliomas Anticancer Res. 2013 May; 33(5): 2047–2056.
35. Clinical Development in Dendritic Cell Based Immunotherapy Journal of Stem Cell Research &Therapeutics. Volume 1 Issue 2 – 2016
36. Successful immunological treatment of gallbladder cancer in India. J Zhejiang Univ SCIENCE B 20067(9):719-724
37. Cancer immunotherapy via dendritic cells. NATURE REVIEWS. VOLUME 12 | APRIL 2012, 265-277
38. Dendritic Cell Immunotherapy for the Treatment of Neoplastic Disease. Biology of Blood and Marrow Transplantation 12:113-125 (2006)
39. GAO, Daiqing, et al. Autologous tumor lysate-pulsed dendritic cell immunotherapy with cytokine-inducedkiller cells improves survival in gastric and colorectal cancer patients. PloS one, 2014, vol. 9, no 4, p. e93886.
40. Hoffmann, J. M., Schmitt, M., Ni, M., & Schmitt, A. (2017). Next-generation dendritic cell- based vaccines for leukemia patients.
41. Anguille, S., Van Tendeloo, V., & Berneman, Z. (2012). Dendritic cell-based therapeutic vaccination for acute myeloid leukemia. Bulletin du cancer, 99(6), 635-642.
42. VAN DE VELDE, A. L., Berneman, Z. N., & VAN TENDELOO, V. F. (2008). L’immunothérapie des cancers hématologiques par les cellules dendritiques. Bulletin du cancer, 95(3), 320-326.
43. Schott, M., Seissler, J., Lettmann, M., Fouxon, V., Scherbaum, W. A., & Feldkamp, J. (2001). Immunotherapy for medullary thyroid carcinoma by dendritic cell vaccination. The Journal of Clinical Endocrinology & Metabolism, 86(10), 4965-4969.
44. Palucka, K., & Banchereau, J. (2012). Cancer immunotherapy via dendritic cells. Nature Reviews Cancer, 12(4), 265-277.
45. Hirschowitz, E. A., Foody, T., Kryscio, R., Dickson, L., Sturgill, J., & Yannelli, J. (2004). Autologous dendriticcell vaccines for non–small-cell lung cancer. Journal of Clinical Oncology, 22(14), 2808-2815.
46. Nestle, F. O., Alijagic, S., Gilliet, M., Sun, Y., Grabbe, S., Dummer, R., … & Schadendorf, D. (1998). Vaccination of melanoma patients with peptide-or tumorlysate-pulsed dendritic cells. Nature medicine, 4(3), 328-332.
47. Okamoto M, Kobayashi M, Yonemitsu Y, Koido S, Homma S. Dendritic cell-based vaccine for pancreatic cancer in Japan. World Journal of Gastrointestinal Pharmacology and Therapeutics. 2016;7(1):133-138. doi:10.4292/wjgpt.v7.i1.133.
48. Mulé, J. J. (2009). Dendritic Cell-Based Vaccines for Pancreatic Cancer and Melanoma. Annals of the NewYork Academy of Sciences, 1174(1), 33-40.
49. Burgdorf, S. K. (2010). Dendritic cell vaccination of patients with metastatic colorectal cancer.
Dan Med Bull, 57(9), B4171.
50. Dendritic Cell Immunotherapy for the Treatment of Neoplastic Disease. Decker, William K. et al. Biologyof Blood and Marrow Transplantation, Volume 12, Issue 2 , 113 – 125
51. DNJ Hart1 and GR Hill1. Dendritic cell immunotherapy for cancer: Application to low-grade lymphoma and multiple mieloma; Immunology and Cell Biology (1999) 77, 451–459; doi:10.1046/j.1440- 1711.1999.00859.x
52. Immunotherapy. 2010 Jan 1; 2(1): 57. Personalized dendritic cell-based tumor immunotherapy. Nona Janikashvili,1 Nicolas Larmonier,1,2 and Emmanuel Katsanis1,2,3,†
53. LOPEZ, Mercedes et al. Avances en inmunoterapia celular contra el melanoma maligno.Rev. méd.
Chile
[online]. 2004, vol.132, n.9 [citado 2017-06-06], pp.1115-1126.
54. GATO, M. et al. Inmunoterapia genética con células dendríticas para el tratamiento del cáncer.
Anales Sis San Navarra [online]. 2015, vol.38, n.2 [citado 2017-06-06], pp.279-287
55. Lancet Oncol. 2014 Jun;15(7):e257-67. doi: 10.1016/S1470-2045(13)70585-0. Clinical use of dendriticcells for cancer therapy. Anguille S1, Smits EL2, Lion E3, van Tendeloo VF3, Berneman ZN4.
56. Immunity. 2013 Jul 25;39(1):38-48. doi: 10.1016/j.immuni.2013.07.004..Dendritic-cell-based therapeuticcancer vaccines. Palucka K1, Banchereau J.
57. ARANGO PRADO, María del C. y GONZALEZ SANCHEZ, Alicia. Vacunas terapéuticas en cáncer: Ensayosclínicos actuales. Rev cubana med [online]. 2002, vol.41, n.6 [citado 2017- 06-06],
pp. 0-0 .
58. BERMUDEZ-MORALES, Víctor Hugo; PERALTA-ZARAGOZA, Oscar y MADRID-MARINA,
Vicente. Terapia génica con citocinas contra cáncer cervicouterino. Salud pública Méx
[online]. 2005, vol.47, n.6 [citado 2017-06-06], pp.458-468.
59. Droppelmann M, Nicolás Et Al. Nuevas Terapias Sistémicas Para El Tratamiento Del Melanoma. Rev Chil Cir
[Online]. 2016, Vol.68, N.1 [Citado 2017-06-06], Pp.81-86.
60. Bull Cancer. 2012 Jun;99(6):635-42. Dendritic cell-based therapeutic vaccination for acute myeloid leukemia. Anguille S1, Van Tendeloo V, Berneman Z.
61. Teilo H. Schaller & John H. Sampson (2016): Advances and challenges: dendritic cell vaccination strategies for glioblastoma, Expert Review of Vaccines, DOI: 10.1080/14760584.2016.1218762
62. INOGES, S. et al. Inmunoterapia activa en el tratamiento de neoplasias hematológicas.Anales Sis SanNavarra [online]. 2004, vol.27, n.1 [citado 2017-06-06], pp.45-62.
63. Mature autologous dendritic cell vaccines in advanced non-small cell lung cancer: a phase I pilotstudy.Perroud MW Jr et al. J Exp Clin Cancer Res. (2011)
64. Autologous dendritic cell vaccines for non-small-cell lung cancer. Hirschowitz EA et al. J Clin Oncol. (2004)
65. Molecular and clinical oncology 4: 129-133, 2016. Clinical outcome of immunotherapy with dendritic cellvaccine and cytokine-induced killer cell therapy in hepatobiliary and pancreatic cancer. Lihong zhang1, wei zhu2, jiali li3, xuejing yang3, yanjie ren3, jingxiu niu3 and yan pang3
66. Brenner H, Kloor M, Pox CP. Colorectal cancer. Lancet. 2014;383:1490–1502. [PubMed]
67. Kerr D. Clinical development of gene therapy for colorectal cancer. Nat Rev Cancer. 2003;3:615– 622. [PubMed]
68. Koido S, Ohkusa T, Homma S, Namiki Y, Takakura K, Saito K, Ito Z, Kobayashi H, Kajihara M, Uchiyama K, et al. Immunotherapy for colorectal cancer. World J Gastroenterol. 2013;19:8531–8542. [PMC free article][PubMed]
69. Koido S, Hara E, Homma S, Torii A, Toyama Y, Kawahara H, Watanabe M, Yanaga K, Fujise K, Tajiri H, et al.Dendritic cells fused with allogeneic colorectal cancer cell line present multiple colorectal cancer-specificantigens and induce antitumor immunity against autologous tumor cells. Clin Cancer Res. 2005;11:7891–7900. [PubMed]
70. Zhu MZ, Marshall J, Cole D, Schlom J, Tsang KY. Specific cytolytic T-cell responses to human CEA from patients immunized with recombinant avipox-CEA vaccine. Clin Cancer Res. 2000;6:24–33. [PubMed]
71. Berinstein NL. Carcinoembryonic antigen as a target for therapeutic anticancer vaccines: a review. J Clin Oncol. 2002;20:2197–2207. [PubMed]
72. Oji Y, Ogawa H, Tamaki H, Oka Y, Tsuboi A, Kim EH, Soma T, Tatekawa T, Kawakami M, Asada M, et al. Expression of the Wilms’ tumor gene WT1 in solid tumors and its involvement in
tumor cell growth. Jpn JCancer Res. 1999;90:194–204. [PubMed]
73. Shimodaira S, Sano K, Hirabayashi K, Koya T, Higuchi Y, Mizuno Y, Yamaoka N, Yuzawa M, Kobayashi T, ItoK, et al. Dendritic Cell-Based Adjuvant Vaccination Targeting Wilms’ Tumor 1 in Patients with Advanced Colorectal Cancer. Vaccines (Basel) 2015;3:1004–1018. [PMC free article][PubMed]
74. Ajioka Y, Allison LJ, Jass JR. Significance of MUC1 and MUC2 mucin expression in colorectal cancer. J Clin Pathol. 1996;49:560–564.[PMC free article] [PubMed]
75. Mashino K, Sadanaga N, Tanaka F, Yamaguchi H, Nagashima H, Inoue H, Sugimachi K, Mori
M. Expression of multiple cancer-testis antigen genes in gastrointestinal and breast carcinomas. Br J Cancer. 2001;85:713–720.[PMC free article] [PubMed]
76. Li M, Yuan YH, Han Y, Liu YX, Yan L, Wang Y, Gu J. Expression profile of cancer-testis genes in
121 human colorectal cancer tissue and adjacent normal tissue. Clin Cancer Res. 2005;11:1809–1814. [PubMed]
77. Sang M, Lian Y, Zhou X, Shan B. MAGE-A family: attractive targets for cancer immunotherapy. Vaccine. 2011;29:8496–8500. [PubMed]
78. Speetjens FM, Kuppen PJ, Welters MJ, Essahsah F, Voet van den Brink AM, Lantrua MG, Valentijn AR, Oostendorp J, Fathers LM, Nijman HW, et al. Induction of p53-specific immunity by a p53 synthetic long peptide vaccine in patients treated for metastatic colorectal cancer. Clin Cancer Res. 2009;15:1086– 1095.[PubMed]
79. Grizzi F, Bianchi P, Malesci A, Laghi L. Prognostic value of innate and adaptive immunity in colorectal cancer. World J Gastroenterol. 2013;19:174–184. [PMC free article] [PubMed]
80. Ahmed D, Eide PW, Eilertsen IA, Danielsen SA, Eknæs M, Hektoen M, Lind GE, Lothe RA. Epigenetic and genetic features of 24 colon cancer cell lines. Oncogenesis. 2013;2:e71. [PMC free article] [PubMed]
81. Takahara A, Koido S, Ito M, Nagasaki E, Sagawa Y, Iwamoto T, Komita H, Ochi T, Fujiwara H, Yasukawa M, et al. Gemcitabine enhances Wilms’ tumor gene WT1 expression and sensitizes human pancreatic cancer cells with WT1-specific T-cell-mediated antitumor immune response. Cancer Immunol Immunother.2011;60:1289–1297. [PubMed]
82. Koido S, Homma S, Takahara A, Namiki Y, Komita H, Uchiyama K, Ito M, Gong J, Ohkusa T, Tajiri H. Immunotherapy synergizes with chemotherapy targeting pancreatic cancer. Immunotherapy. 2012;4:5– 7.[PubMed]
83. Al-Ejeh F, Darby JM, Brown MP. Chemotherapy synergizes with radioimmunotherapy targeting La autoantigen in tumors. PLoS One. 2009;4:e4630. [PMC free article] [PubMed]
84. Boon T, Coulie PG, Van den Eynde B. Tumor antigens recognized by T cells. Immunol Today. 1997;18:267–
268. [PubMed]
85. Steinman RM, Swanson J. The endocytic activity of dendritic cells. J Exp Med. 1995;182:283–
288. [PMC free article] [PubMed]
86. Tanaka Y, Koido S, Ohana M, Liu C, Gong J. Induction of impaired antitumor immunity by fusion of MHC class II-deficient dendritic cells with tumor cells. J Immunol. 2005;174:1274– 1280. [PubMed]
87. Adam C, King S, Allgeier T, Braumüller H, Lüking C, Mysliwietz J, Kriegeskorte A, Busch DH, Röcken M, Mocikat R. DC-NK cell cross talk as a novel CD4+ T-cell-independent pathway for antitumor CTL induction.Blood. 2005;106:338–344. [PubMed]
88. van Beek JJ, Wimmers F, Hato SV, de Vries IJ, Sköld AE. Dendritic cell cross talk with innate and innate-likeeffector cells in antitumor immunity: implications for DC vaccination. Crit Rev Immunol. 2014;34:517– 536.[PubMed]
89. Wehner R, Dietze K, Bachmann M, Schmitz M. The bidirectional crosstalk between human dendritic cellsand natural killer cells. J Innate Immun. 2011;3:258–263. [PubMed]
90. Steinman RM, Banchereau J. Taking dendritic cells into medicine. Nature. 2007;449:419–426. [PubMed]
91. Nestle FO, Alijagic S, Gilliet M, Sun Y, Grabbe S, Dummer R, Burg G, Schadendorf D. Vaccination of melanoma patients with peptide- or tumor lysate-pulsed dendritic cells. Nat Med. 1998;4:328–
332. [PubMed]
92. Koido S, Homma S, Okamoto M, Takakura K, Mori M, Yoshizaki S, Tsukinaga S, Odahara S,
Koyama S, ImazuH, et al. Treatment with chemotherapy and dendritic cells pulsed with multiple Wilms’ tumor 1 (WT1)- specific MHC class I/II-restricted epitopes for pancreatic cancer. Clin Cancer Res. 2014;20:4228– 4239. [PubMed]
93. Kimura Y, Tsukada J, Tomoda T, Takahashi H, Imai K, Shimamura K, Sunamura M, Yonemitsu Y, ShimodairaS, Koido S, et al. Clinical and immunologic evaluation of dendritic cell-based immunotherapy in combination with gemcitabine and/or S-1 in patients with advanced pancreaticcarcinoma. Pancreas. 2012;41:195–205. [PubMed]
94. Gilboa E, Vieweg J. Cancer immunotherapy with mRNA-transfected dendritic cells. Immunol Rev. 2004;199:251–263. [PubMed]
95. Mackensen A, Herbst B, Chen JL, Köhler G, Noppen C, Herr W, Spagnoli GC, Cerundolo V, Lindemann A. Phase I study in melanoma patients of a vaccine with peptide-pulsed dendritic cells generated in vitro from CD34(+) hematopoietic progenitor cells. Int J Cancer. 2000;86:385–392. [PubMed]
96. Palucka K, Ueno H, Banchereau J. Recent developments in cancer vaccines. J Immunol. 2011;186:1325–1331. [PMC free article] [PubMed]
97. Gong J, Chen D, Kashiwaba M, Kufe D. Induction of antitumor activity by immunization with fusions ofdendritic and carcinoma cells. Nat Med. 1997;3:558–561. [PubMed]
98. Gong J, Koido S, Calderwood SK. Cell fusion: from hybridoma to dendritic cell-based vaccine. Expert RevVaccines. 2008;7:1055–1068.[PubMed]
99. Cavallo F, Curcio C, Forni G. Immunotherapy and immunoprevention of cancer: where do we stand?Expert Opin Biol Ther. 2005;5:717–726.[PubMed]
100. Giorda E, Sibilio L, Martayan A, Moretti S, Venturo I, Mottolese M, Ferrara GB, Cappellacci S, Eibenschutz L, Catricalà C, et al. The antigen processing machinery of class I human leukocyte antigens: linked patterns of gene expression in neoplastic cells. Cancer Res. 2003;63:4119–4127.[PubMed]
101. Koido S, Homma S, Takahara A, Namiki Y, Tsukinaga S, Mitobe J, Odahara S, Yukawa T, MatsudairaH, Nagatsuma K, et al. Current immunotherapeutic approaches in pancreatic cancer. Clin Dev Immunol. 2011;2011:267539. [PMC free article] [PubMed]
102. Koido S, Homma S, Hara E, Namiki Y, Takahara A, Komita H, Nagasaki E, Ito M, Ohkusa T, Gong J, et al. Regulation of tumor immunity by tumor/dendritic cell fusions. Clin Dev Immunol. 2010;2010:516768.[PMC free article] [PubMed]
103. Adachi K, Tamada K. Immune checkpoint blockade opens an avenue of cancer immunotherapy with a potent clinical efficacy. Cancer Sci. 2015;106:945–950. [PMC free article] [PubMed]
104. Droeser RA, Hirt C, Viehl CT, Frey DM, Nebiker C, Huber X, Zlobec I, Eppenberger-Castori S, Tzankov A, Rosso R, et al. Clinical impact of programmed cell death ligand 1 expression in colorectal cancer. Eur J Cancer. 2013;49:2233–2242. [PubMed]
105. Anitei MG, Zeitoun G, Mlecnik B, Marliot F, Haicheur N, Todosi AM, Kirilovsky A, Lagorce C, BindeaG, Ferariu D, et al. Prognostic and predictive values of the immunoscore in patients with rectal cancer. ClinCancer Res. 2014;20:1891–1899. [PubMed]
106. Merika E, Saif MW, Katz A, Syrigos K, Morse M. Review. Colon cancer vaccines: an update. In Vivo.2010;24:607–628. [PubMed]
107. Quigley DA, Kristensen V. Predicting prognosis and therapeutic response from interactions between lymphocytes and tumor cells. Mol Oncol. 2015;9:2054–2062. [PubMed]
108. Shi SJ, Wang LJ, Wang GD, Guo ZY, Wei M, Meng YL, Yang AG, Wen WH. B7-H1 expression is associated with poor prognosis in colorectal carcinoma and regulates the proliferation and invasion of HCT116 colorectal cancer cells. PLoS One. 2013;8:e76012. [PMC free article] [PubMed]
109. Wu P, Wu D, Li L, Chai Y, Huang J. PD-L1 and Survival in Solid Tumors: A Meta-Analysis. PLoS One.2015;10:e0131403.[PMC free article] [PubMed]
110. Zhao LW, Li C, Zhang RL, Xue HG, Zhang FX, Zhang F, Gai XD. B7-H1 and B7-H4 expression in colorectal carcinoma: correlation with tumor FOXP3(+) regulatory T-cell infiltration. Acta Histochem. 2014;116:1163–1168. [PubMed]
111. Morse MA, Deng Y, Coleman D, Hull S, Kitrell-Fisher E, Nair S, Schlom J, Ryback ME, Lyerly HK. A Phase I study of active immunotherapy with carcinoembryonic antigen peptide (CAP-1)-pulsed, autologous human cultured dendritic cells in patients with metastatic
malignancies expressing carcinoembryonic antigen. Clin Cancer Res. 1999;5:1331–1338. [PubMed]
112. Morse MA, Nair SK, Mosca PJ, Hobeika AC, Clay TM, Deng Y, Boczkowski D, Proia A, Neidzwiecki D, Clavien PA, et al. Immunotherapy with autologous, human dendritic cells transfected with carcinoembryonic antigen mRNA. Cancer Invest. 2003;21:341–349. [PubMed]
113. Morse MA, Clay TM, Hobeika AC, Osada T, Khan S, Chui S, Niedzwiecki D, Panicali D, Schlom J, Lyerly HK. Phase I study of immunization with dendritic cells modified with fowlpox encoding carcinoembryonic antigen and costimulatory molecules. Clin Cancer Res. 2005;11:3017–3024. [PubMed]
114. Osada T, Clay T, Hobeika A, Lyerly HK, Morse MA. NK cell activation by dendritic cell vaccine: a mechanism of action for clinical activity. Cancer Immunol Immunother. 2006;55:1122–1131. [PubMed]
115. Lion E, Smits EL, Berneman ZN, Van Tendeloo VF. NK cells: key to success of DC-based cancer vaccines? Oncologist. 2012;17:1256–1270.[PMC free article] [PubMed]
116. Sakakibara M, Kanto T, Hayakawa M, Kuroda S, Miyatake H, Itose I, Miyazaki M, Kakita N,Higashitani K, Matsubara T, et al. Comprehensive immunological analyses of colorectal cancer patients inthe phase I/II study of quickly matured dendritic cell vaccine pulsed with carcinoembryonic antigen peptide. Cancer Immunol Immunother. 2011;60:1565– 1575.[PubMed]
117. Fong L, Hou Y, Rivas A, Benike C, Yuen A, Fisher GA, Davis MM, Engleman EG. Altered peptide ligand vaccination with Flt3 ligand expanded dendritic cells for tumor immunotherapy. Proc Natl Acad SciUSA. 2001;98:8809–8814. [PMC free article] [PubMed]
118. Itoh T, Ueda
119. Y, Kawashima I, Nukaya I, Fujiwara H, Fuji N, Yamashita T, Yoshimura T, Okugawa K, Iwasaki T, et al. Immunotherapy of solid cancer using dendritic cells pulsed with the HLA-A24- restricted peptide of carcinoembryonic antigen. Cancer Immunol Immunother. 2002;51:99– 106.[PubMed]
120. Liu KJ, Wang CC, Chen LT, Cheng AL, Lin DT, Wu YC, Yu WL, Hung YM, Yang HY, Juang SH, et al. Generation of carcinoembryonic antigen (CEA)-specific T-cell responses in HLA- A*0201 and HLA-A*2402 late-stage colorectal cancer patients after vaccination with dendritic cells loaded with CEA peptides. Clin Cancer Res. 2004;10:2645–2651. [PubMed]
121. Matsuda K, Tsunoda T, Tanaka H, Umano Y, Tanimura H, Nukaya I, Takesako K, Yamaue H. Enhancement of cytotoxic T-lymphocyte responses in patients with gastrointestinal malignancies following vaccination with CEA peptide-pulsed dendritic cells. Cancer Immunol Immunother. 2004;53:609–616. [PubMed]
122. Ueda Y, Itoh T, Nukaya I, Kawashima I, Okugawa K, Yano Y, Yamamoto Y, Naitoh K, Shimizu K, Imura K, et al. Dendritic cell-based immunotherapy of cancer with carcinoembryonic antigen-derived, HLA-A24-restricted CTL epitope: Clinical outcomes of 18 patients with metastatic gastrointestinal or lung adenocarcinomas. Int J Oncol. 2004;24:909– 917. [PubMed]
123. Lesterhuis WJ, de Vries IJ, Schuurhuis DH, Boullart AC, Jacobs JF, de Boer AJ, Scharenborg NM, Brouwer HM, van de Rakt MW, Figdor CG, et al. Vaccination of colorectal cancer patients with CEA-loadeddendritic cells: antigen-specific T cell responses in DTH skin tests. Ann Oncol. 2006;17:974– 980. [PubMed]
124. Babatz J, Röllig C, Löbel B, Folprecht G, Haack M, Günther H, Köhne CH, Ehninger G, Schmitz M, Bornhäuser M. Induction of cellular immune responses against carcinoembryonic antigen in patients withmetastatic tumors after vaccination with altered peptide ligand- loaded dendritic cells. Cancer Immunol Immunother. 2006;55:268–276. [PubMed]
125. Oji Y, Yamamoto H, Nomura M, Nakano Y, Ikeba A, Nakatsuka S, Abeno S, Kiyotoh E, Jomgeow T, Sekimoto M, et al. Overexpression of the Wilms’ tumor gene WT1 in colorectal adenocarcinoma. Cancer Sci. 2003;94:712–717. [PubMed]
126. Miyata Y, Kumagai K, Nagaoka T, Kitaura K, Kaneda G, Kanazawa H, Suzuki S, Hamada Y, Suzuki R. Clinicopathological significance and prognostic value of Wilms’ tumor gene expression in colorectal cancer. Cancer Biomark. 2015;15:789–797. [PubMed]
127. Cheever MA, Allison JP, Ferris AS, Finn OJ, Hastings BM, Hecht TT, Mellman I, Prindiville SA, Viner JL, Weiner LM, et al. The prioritization of cancer antigens: a national
cancer institute pilot project for theacceleration of translational research. Clin Cancer Res. 2009;15:5323–5337. [PubMed]
128. Oka Y, Sugiyama H. WT1 peptide vaccine, one of the most promising cancer vaccines: its present status and the future prospects. Immunotherapy. 2010;2:591–594. [PubMed]
129. Sugiyama H. WT1 (Wilms’ tumor gene 1): biology and cancer immunotherapy. Jpn J Clin Oncol. 2010;40:377–387. [PubMed]
130. Chemoimmunotherapy targeting Wilms’ tumor 1 (WT1)-specific cytotoxic T lymphocyte andhelperT cell responses for patients with pancreatic cancer. Oncoimmunology. 2014;3:e958950. [PMC free article][PubMed]
131. Sadanaga N, Nagashima H, Mashino K, Tahara K, Yamaguchi H, Ohta M, Fujie T, Tanaka F, Inoue H, Takesako K, et al. Dendritic cell vaccination with MAGE peptide is a novel therapeutic approach for gastrointestinal carcinomas. Clin Cancer Res. 2001;7:2277–2284. [PubMed]
132. Tanaka F, Haraguchi N, Isikawa K, Inoue H, Mori M. Potential role of dendritic cell vaccination withMAGE peptides in gastrointestinal carcinomas. Oncol Rep. 2008;20:1111– 1116. [PubMed
133. Morse MA, Niedzwiecki D, Marshall JL, Garrett C, Chang DZ, Aklilu M, Crocenzi TS, Cole DJ, Dessureault S, Hobeika AC, et al. A randomized phase II study of immunization with dendritic cells modifiedwith poxvectors encoding CEA and MUC1 compared with the same poxvectors plus GM-CSF forresected metastatic colorectal cancer. Ann Surg. 2013;258:879– 886. [PMC free article] [PubMed]
134. Mohebtash M, Tsang KY, Madan RA, Huen NY, Poole DJ, Jochems C, Jones J, Ferrara T, Heery CR, Arlen PM, et al. A pilot study of MUC-1/CEA/TRICOM poxviral-based vaccine in patients with metastatic breast and ovarian cancer. Clin Cancer Res. 2011;17:7164– 7173.[PMC free article] [PubMed]
135. Brossart P, Stuhler G, Flad T, Stevanovic S, Rammensee HG, Kanz L, Brugger W. Her- 2/neu-derivedpeptides are tumor-associated antigens expressed by human renal cell and colon carcinoma lines and arerecognized by in vitro induced specific cytotoxic T lymphocytes. Cancer Res. 1998;58:732–736. [PubMed]
136. Kavanagh B, Ko A, Venook A, Margolin K, Zeh H, Lotze M, Schillinger B, Liu W, Lu Y, Mitsky P, et al.Vaccination of metastatic colorectal cancer patients with matured dendritic cells loaded with multiple major histocompatibility complex class I peptides. J Immunother. 2007;30:762–772. [PubMed]
137. Brossart P, Heinrich KS, Stuhler G, Behnke L, Reichardt VL, Stevanovic S, Muhm A, Rammensee HG, Kanz L, Brugger W. Identification of HLA-A2-restricted T-cell epitopes derived from the MUC1 tumor antigen for broadly applicable vaccine therapies. Blood. 1999;93:4309–4317. [PubMed]
138. de Gruijl TD, van den Eertwegh AJ, Pinedo HM, Scheper RJ. Whole-cell cancer vaccination: from autologous to allogeneic tumor- and dendritic cell-based vaccines. Cancer Immunol Immunother. 2008;57:1569–1577.[PMC free article] [PubMed]
139. Koido S, Kashiwaba M, Chen D, Gendler S, Kufe D, Gong J. Induction of antitumor immunity by vaccination of dendritic cells transfected with MUC1 RNA. J Immunol. 2000;165:5713–5719. [PubMed]
140. Nair SK, Hull S, Coleman D, Gilboa E, Lyerly HK, Morse MA. Induction of carcinoembryonic antigen (CEA)-specific cytotoxic T-lymphocyte responses in vitro using autologous dendritic cells loaded with CEApeptide or CEA RNA in patients with metastatic malignancies expressing CEA. Int J Cancer. 1999;82:121–
124. [PubMed]
141. Rains N, Cannan RJ, Chen W, Stubbs RS. Development of a dendritic cell (DC)-based vaccine for patients with advanced colorectal cancer. Hepatogastroenterology. 2001;48:347–
351. [PubMed]
142. Kajihara M, Takakura K, Ohkusa T, Koido S. The impact of dendritic cell-tumor fusion cells on cancervaccines – past progress and future strategies. Immunotherapy. 2015;7:1111– 1122. [PubMed]
143. Galea-Lauri J, Darling D, Mufti G, Harrison P, Farzaneh F. Eliciting cytotoxic T lymphocytes against acute myeloid leukemia-derived antigens: evaluation of dendritic cell- leukemia cell hybrids and other antigen-loading strategies for dendritic cell-based
La inmunoterapia de células dendríticas es uno de los tratamientos más publicados en los últimos 50 años, tanto a nivel de artículos científicos validados, reportes de los ciclos de ensayo y literatura de referencia (ver portadas de textos disponibles). Ya no existe duda de qué es, como funciona y para que aplica. La interrogante solo es: Que centros logran efectuar de mejor forma la práctica de dichos protocolos (similar interrogante a que cirujano opera mejor, que patólogo diagnóstica mejor, etc).